


近期,我院白津教授团队聚焦于肾细胞癌中的铁死亡分子调控机制,揭示了蛋白精氨酸甲基转移酶5(PRMT5)通过精氨酸对称性二甲基化修饰长链脂酰辅酶A合成酶4(ACSL4),促进其蛋白降解,从而抑制肾癌细胞脂质过氧化水平并降低细胞对铁死亡的敏感性。该研究首次明确了PRMT5在肾癌细胞铁死亡调控中的关键作用,为肾癌治疗提供了新的策略与潜在靶点。相关成果以“PRMT5-Mediated Arginine Methylation of ACSL4 Attenuates Its Stability and Suppresses Ferroptosis in Renal Cancer”为题发表在Research上(Research,2025, DOI: 10.34133/research.0789)。
研究背景
肾细胞癌(RCC)是最常见的泌尿系统恶性肿瘤之一,临床治疗以手术切除为主,晚期患者常依赖靶向治疗及免疫检查点抑制剂(ICIs)等系统性治疗手段。尽管免疫治疗在部分RCC患者中取得了显著疗效,但仍存在相当比例的患者对治疗无响应或发生获得性耐药,限制了其临床获益。因此,深入探索RCC免疫逃逸机制,挖掘调控免疫敏感性的关键分子,对于优化免疫治疗策略、提高治疗效果具有重要意义。
近年来,铁死亡(Ferroptosis)作为一种依赖于脂质过氧化反应的细胞程序性死亡方式,在调控肿瘤进展与抗肿瘤免疫中受到广泛关注。研究表明,铁死亡可通过诱导肿瘤细胞免疫原性死亡,增强免疫检查点抑制剂的治疗效果。蛋白精氨酸甲基转移酶5(PRMT5)作为一类关键的表观遗传调控酶,能够催化底物蛋白精氨酸位点发生对称性二甲基化(SDMA)修饰,进而影响其稳定性、定位及功能活性。白津教授与李中伟教授团队2025年1月发表在Research期刊上的研究发现:PRMT5能通过甲基化修饰ALKBH5来增加CD276表达,从而调控结直肠的免疫逃逸进程(Research,2025 Jan 8:8:0549. doi: 10.34133/research.0549.)。
然而,PRMT5在肾癌(RCC)中是否通过调节铁死亡影响免疫治疗敏感性尚不明确。基于此,围绕PRMT5调控铁死亡及其在免疫治疗中的功能,深入解析其作用机制,将有望为RCC提供全新的治疗策略和靶点支持。
研究进展
本研究揭示了PRMT5通过抑制ACSL4表达调控肾癌细胞铁死亡的新机制,并突显了PRMT5抑制剂(GSK3326595)作为潜在抗肿瘤新药的应用前景(图1)。
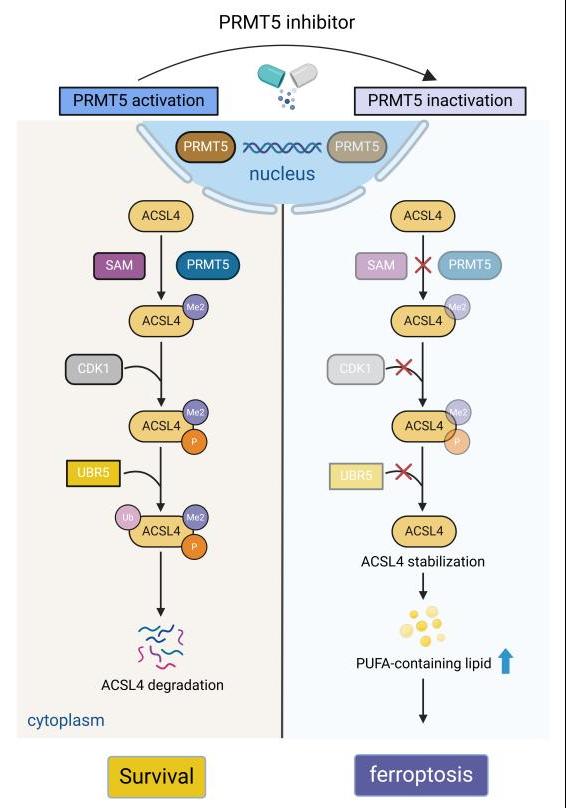
图1 PRMT5参与调节肾细胞癌铁死亡的作用机制
首先,在包含765种表观遗传的化合物文库中使用RSL3诱导的肾癌细胞铁死亡模型进行筛选,发现多种PRMT5抑制剂可显著促进RSL-3诱导的肾癌细胞铁死亡。利用细胞实验进一步验证了PRMT5能够抑制RSL-3诱导的肾癌细胞脂质过氧化水平并提高细胞活力(图2)。
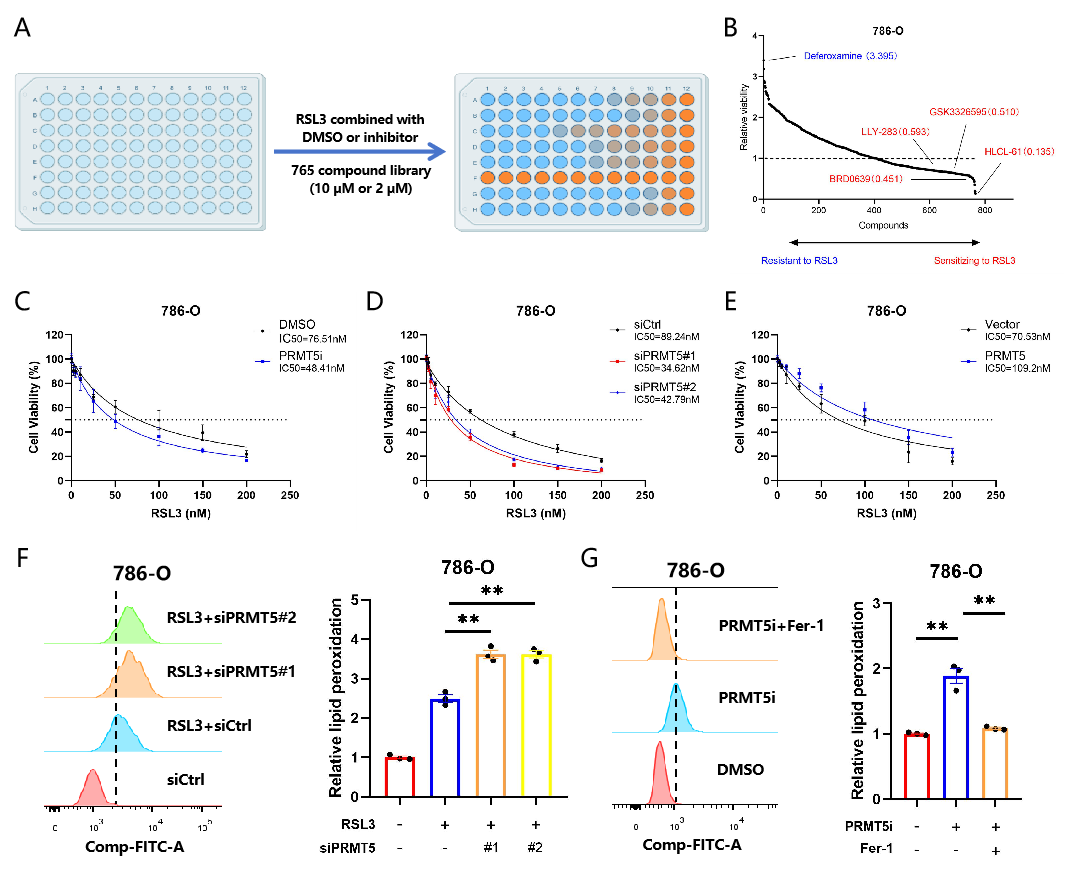
图2PRMT5抑制肾细胞癌的铁死亡表型
对比分析蛋白结合质谱中PRMT5的潜在结合蛋白与铁死亡相关研究数据库FerrDb中铁死亡相关标志物,得到了25个PRMT5的潜在底物并依据结合肽段数量进行排序。对这些潜在底物进行验证发现仅有长链脂酰辅酶A合成酶4(ACSL4)的表达在敲低PRMT5后上调,而其他底物的表达没有明显的变化(图3)。
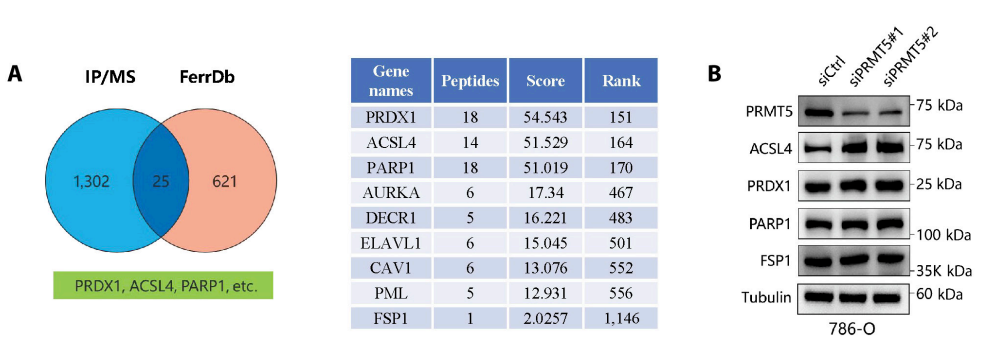
图3PRMT5抑制ACSL4的表达
蛋白修饰质谱分析提示ACSL4有两个精氨酸残基(R380和R549)可能被PRMT5介导的SDMA修饰。构建两个位点R到K的突变质粒,并通过IP实验验证发现只有R549位点的突变抑制了ACSL4的SDMA水平(图4)。我们的研究最终证实ACSL4的R549 SDMA修饰在ACSL4的泛素化降解中发挥关键作用。
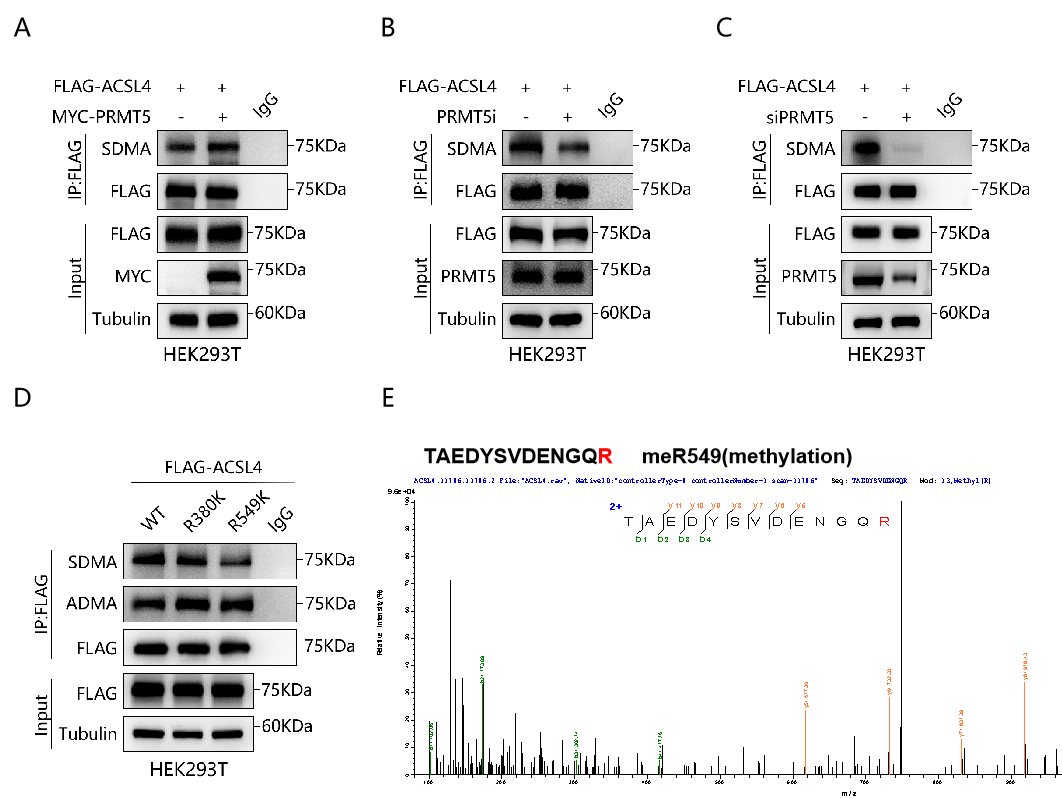
图4PRMT5在ACSL4形成SDMA修饰的位点
未来展望
本研究的发现为PRMT5在肾癌治疗中的临床应用开辟了新的方向。基于其通过甲基化修饰ACSL4抑制铁死亡的关键作用,未来可针对PRMT5的结构特征开发选择性更高、脱靶效应更低的小分子抑制剂,以最大程度提升疗效并降低毒副作用。同时,PRMT5抑制与免疫检查点阻断联合应用的潜力值得在更多动物模型及临床试验中深入验证,以评估其在改善免疫应答、延缓肿瘤进展方面的优势。整体而言,该研究不仅丰富了铁死亡调控网络的理论体系,还为推动肾癌治疗模式从单一策略向多靶点、联合化方向发展奠定了坚实基础。